Wechselwirkung (= WW) zwischen Molekülen
Was du können solltest:
- Das sichere Aufstellen von Valenzstrichformeln.
Elektronegativität (=EN) und Polarität
ΔUm im weiteren Verlauf erklären zu können, wie Moleküle miteinander wechselwirken, muss man sich zunächst mit der Elektronendichteverteilung auseinandersetzen. Diese lässt sich mithilfe der EN, welche man aus dem PSE ablesen kann, erklären. Die Elektronendichteverteilung ist dabei die Auswirkung von Elektronegativitätsdifferenzen (= ΔEN) welche unter den richtigen Bedingungen zu polaren bzw. unpolaren Molekülen führen.
Wie man sich bei den ganzen Fachbegriffen gut zurechtfindet ist anschaulich im Lehrvideo dazu erklärt.
Liegt ein Dipol vor?
Um bestimmen zu können, welche WW zwischen Molekülen vorliegen, muss man zunächst das einzelne Molekül genauer betrachten. Für das Wechselspiel mit anderen Molekülen ist dabei besonders wichtig, ob es sich um einen Dipol oder um eben keinen handelt. Die Konzepte, welche zur Bestimmung benötigt werden, sind sowohl die EN als auch das Elektronen-Paar-Abstoßungs-Modell (=EPA). Aus dem Englischen kennt man dafür die Bezeichnung VSEPR (= Valence Shell Electron Pair Repulsion)
Wechselwirkung Chemie
Im Video werden die drei WW:
- London-Dispersions-WW
- DD-WW
- H-Brücken
genauer behandelt und deren Effekt auf die Siedetemperaturen von Stoffen besprochen.
Fragen zu den Videos:
FAQs
Intermolekulare WW sind Kräfte, die zwischen verschiedenen Molekülen wirken. Intramolekulare WW hingegen sind Kräfte, die innerhalb eines Moleküls zwischen den Atomen wirken und für die chemische Bindung verantwortlich sind. Beispiele für intramolekulare WW sind Ionenbindungen, Metallbindungen und kovalente Bindungen.
Die Stärke der London-Dispersionswechselwirkungen hängt von drei Faktoren ab:
- Oberfläche des Moleküls: Je größer die Oberfläche eines Moleküls, desto stärker sind die London-Dispersionswechselwirkungen.
- Länge der Kohlenstoffkette: Je länger die Kohlenstoffkette eines Moleküls, desto stärker sind die London-Dispersionswechselwirkungen.
- Atomradius: Je größer der Atomradius, desto stärker sind die London-Dispersionswechselwirkungen.
- Das heißt, je mehr Elektronen für die Wechselwirkung zur Verfügung stehen, desto stärker ist diese auch
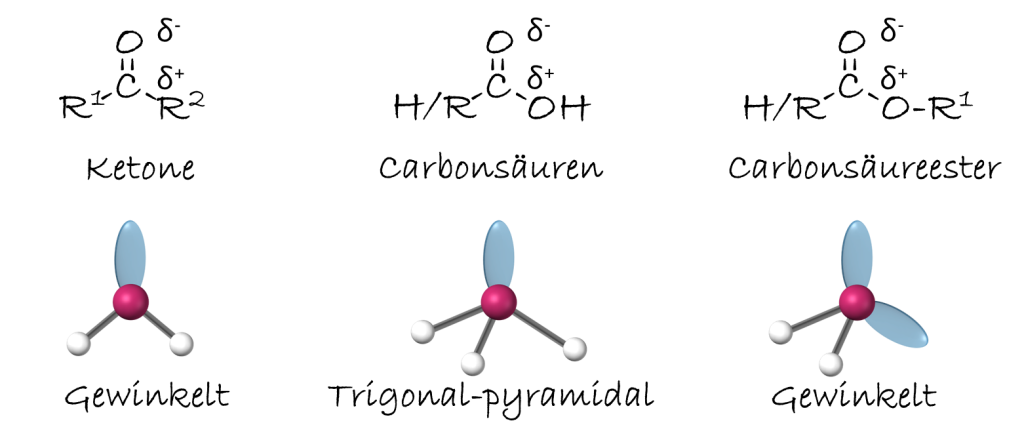
Ein D.pol ist ein Molekül mit einer ungleichmäßigen Ladungsverteilung, d.h. es hat einen positiven und einen negativen Pol. Ob ein Molekül ein D.pol ist, hängt von zwei Faktoren ab:
- Polarität der Bindungen: Die Bindung zwischen zwei Atomen ist polar, wenn die Elektronegativitätsdifferenz zwischen den Atomen zwischen cairca 0,5 und 1,7 liegt.
- Molekülgeometrie: Die räumliche Anordnung der Atome im Molekül bestimmt, ob sich die Polarität der einzelnen Bindungen aufhebt oder zu einem Gesamtd.pol führt.
Die Molekülgeometrie kann mit dem EPA-Modell (Elektronenpaar-Abstoßungs-Modell) bestimmt werden. Dabei betrachtet man die Valenzelektronenpaare am Zentralatom und deren abstoßende Wechselwirkung. Freie Elektronenpaare beanspruchen mehr Raum als bindende Elektronenpaare und beeinflussen die Geometrie stärker.
Folgende Orientierungen sollte man zuordnen kennen:
- linear
- gewinkelt
- trigonal-planar
- trigonal-pyramidal
- tetraedrisch
Wasserstoffbrücken sind besonders starke Dipol-Dipol-Wechselwirkungen, die entstehen, wenn ein Wasserstoffatom an ein stark elektronegatives Atom (N, O, F) gebunden ist und mit einem freien Elektronenpaar eines anderen Atoms (N, O, F) eines anderen Moleküls wechselwirkt. Sie treten z.B. zwischen folgenden Molekülen auf:
- Alkoholen
- Carbonsäuren
- Wasser
Intermolekulare WW halten Moleküle zusammen. Je stärker die WW, desto mehr Energie (in Form von Wärme) muss zugeführt werden, um die Moleküle voneinander zu trennen und den Stoff in den gasförmigen Zustand zu überführen. Daher haben Stoffe mit starken intermolekularen WW höhere Siedetemperaturen als Stoffe mit schwachen WW.
Weiterführende Aufgabestellungen (Ohne Lösungen)
Zusantzinfos
In vielen Bereichen der Chemie spielt die Art und Weise eine Rolle, wie sich Teilchen zueinander verhalten. Diese Beziehungen bestimmen, wie fest Stoffe zusammenhalten, wie leicht sie sich trennen lassen und welche Eigenschaften sie im Alltag zeigen. So erklärt sich beispielsweise, warum manche Substanzen bei niedrigen Temperaturen flüssig bleiben, während andere schon früh erstarren oder verdampfen. Auch die Löslichkeit in verschiedenen Flüssigkeiten hängt davon ab, wie gut sich die Teilchen anordnen und miteinander in Kontakt treten können.
Selbst die Struktur eines Stoffes – ob er eher weich, hart, flexibel oder spröde ist – lässt sich auf diese grundlegenden Zusammenhänge zurückführen. Wer versteht, wie sich Teilchen in der Nähe anderer Teilchen verhalten, kann viele Stoffeigenschaften besser einordnen und vorhersagen. Dadurch wird deutlich, warum bestimmte Materialien für spezielle Anwendungen geeignet sind, etwa in der Technik, im Haushalt oder in biologischen Systemen. deren Effekt auf die Siedetemperaturen von Stoffen besprochen
Viele Eigenschaften von Stoffen lassen sich nur verstehen, wenn man betrachtet, wie sich ihre Teilchen in größeren Gruppen verhalten. Dabei spielt nicht nur die Art der Teilchen eine Rolle, sondern auch, wie sie sich im Raum anordnen und wie stark sie sich gegenseitig beeinflussen. Diese Zusammenhänge erklären zum Beispiel, warum manche Substanzen besonders stabil sind, während andere leicht verformbar oder flüchtig erscheinen.
Auch Temperaturänderungen wirken sich unterschiedlich aus, je nachdem, wie eng die Teilchen beieinander liegen oder wie leicht sie sich voneinander lösen können. Solche Beobachtungen helfen dabei, das Verhalten von Materialien im Alltag besser einzuordnen – sei es beim Erhitzen, Abkühlen, Mischen oder Trennen. Dadurch wird deutlich, dass selbst einfache Experimente oft auf grundlegenden Prinzipien beruhen, die in vielen Bereichen der Chemie eine zentrale Rolle spielen


