
Notwendige Grundlagen:
- Funktionsweise der Neutralisation.
- Das Aufstellen von Oxidationszahlen und das Lösen von Redoxreaktionen.
- Die Benennung von Carbonsäureestern.
Säure Base Titration
Bei der Säure‑Base‑Titration handelt es sich um ein wichtiges Verfahren der quantitativen Analyse, mit dem sich die Konzentration einer unbekannten Lösung präzise bestimmen lässt. Dieses Verfahren spielt nicht nur im Schulunterricht eine große Rolle, sondern wird auch in Laboren der Umweltchemie, Lebensmittelanalytik und Pharmazie regelmäßig eingesetzt.
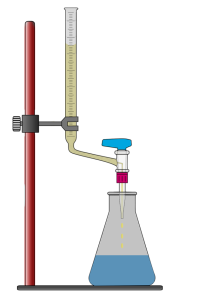
Für die Durchführung benötigt man einen klar definierten Versuchsaufbau: Eine Bürette zur genauen Volumenabgabe, eine Maßlösung bekannter Konzentration sowie eine Probelösung, der meist ein geeigneter Indikator zugesetzt wird. Durch die tropfenweise Zugabe der Maßlsg. kommt es zu einer chemischen Reaktion – der Neutralisationsreaktion – zwischen beiden Lösungen.
Sobald der Äquivalenzpunkt erreicht ist – also der Punkt, an dem die Stoffmengen im richtigen Verhältnis reagieren – zeigt der Indikator einen Farbumschlag. Aus dem verbrauchten Volumen der Maßlsg. lässt sich anschließend die Konzentration der Probelsg. berechnen.
Das hier vorgestellten Verfahren mit Indikatoren liefert zwar gut nachvollziehbare Ergebnisse, sind jedoch nicht besonders genau. Der Farbumschlag kann je nach Indikator und Beobachter leicht variieren. In professionellen Laboren werden deshalb häufig präzise pH‑Meter eingesetzt, die den Endpunkt elektronisch und deutlich zuverlässiger bestimmen.s
Fragen zum Video:
FAQs
Sie ist ein quantitatives Analyseverfahren, das auch als Maßanalyse bezeichnet wird. Sie dient dazu, die unbekannte Konzentration einer Säure oder Base zu bestimmen. Dies geschieht, indem man eine Lösung bekannter Konzentration (= Maßlösung) schrittweise zu der Probelösung unbekannter Konzentration gibt, bis die Neutralisationsreaktion abgeschlossen ist.
Für eine Titration benötigt man folgende Materialien:
- Bürette: Ein Glasrohr mit einem Hahn am unteren Ende, um die Maßlsg. präzise zu dosieren.
- Stativ: Zur Befestigung der Bürette.
- Erlenmeyerkolben: Enthält die Probelsg. mit bekanntem Volumen und einem Indikator.
- Maßlösung: Eine Lösung mit bekannter Konzentration.
- Indikator: Ein Farbstoff, der den Äquivalenzpunkt der Titration durch einen Farbumschlag anzeigt.
Die Konzentration der Probelsg. lässt sich mithilfe folgender Schritte berechnen:
- Reaktionsgleichung aufstellen: Die Reaktionsgleichung der Neutralisationsreaktion zwischen der sauren und der basischen Lösung muss aufgestellt werden.
- Stoffmengenverhältnis bilden: Das Stoffmengenverhältnis zwischen der gesuchten Substanz (in der Probelsg.) und der bekannten Substanz (in der Maßlsg.) muss aus der Reaktionsgleichung abgeleitet werden.
- Variablen einsetzen: Die Formel n = c * V (Stoffmenge = Konzentration * Volumen) wird für beide Substanzen in das Stoffmengenverhältnis eingesetzt.
- Auflösen, Einsetzen und Berechnen: Die Gleichung wird nach der gesuchten Konzentration aufgelöst, die bekannten Werte eingesetzt und die Berechnung durchgeführt.
Der Äquivalenzpunkt ist der Punkt der Titration, an dem die Säure und die Base im stöchiometrischen Verhältnis vollständig miteinander reagiert haben. Er wird durch den Farbumschlag des Indikators angezeigt. Darüber hinaus ist am Äquivalenzpunkt die elektrische Leitfähigkeit der Lösung am geringsten.
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!
Übungen:
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!
Lösungsvideos:
Übung 26.04.2020:
Bei der Untersuchung von 30 mL einer Salpetersäure-Lösung werden bis zur Neutralisation 60 mL einer Natronlauge mit c(NaOH) = 0,15 mol/L benötigt. Berechne die Stoffmengenkonzentration der Salpetersäure.
Übung 26.04.2020:
Bei der Untersuchung von 20 mL einer Phosphorsäure-Lösung werden bis zur Neutralisation 15 mL einer Kalilauge mit c(KOH) = 0,2 mol/L benötigt. Berechne die Stoffmengenkonzentration der Phosphorsäure.
Übung 26.04.2020:
Schwefelsäure der Konzentration c(H2SO4) = 0,25 mol/L wird zum Neutralisieren von 0,4 mol Aluminiumhydroxid-Lösung verwendet. Berechne das benötigte Volumen an Schwefelsäure, um die Lösung vollständig zu neutralisieren.
Übung 26.04.2020:
In einem Messkolben, werden 1,49 g Calciumhydroxid in 200 mL Wasser gelöst. Berechne das benötigte Volumen, um 15 mL einer Salzsäure-Lösung der Konzentration 0,35 mol/L damit zu neutralisieren.
Die Titrationskurve…
… wird erst in der Oberstufe richtig relevant.


