Symbolschreibweise & Isotope einfach erklärt (8. Klasse)
Weiterführende Themen aus dem Bereich der 8. Klasse – Überblick
- Die Berechnung der Dichte
- Endo- & Exotherme Reaktionen
- Stöchiometrie
Was ist die Symbolschreibweise
Die Symbolschreibweise und das Verständnis von Isotopen gehören zu den Grundlagen der Chemie in der 8. Klasse. Beide Themen helfen dabei, Atome richtig zu beschreiben, Informationen aus dem Periodensystem abzulesen und die Zusammensetzung von Atomkernen zu verstehen. Auf dieser Seite lernst du Schritt für Schritt, damit zu arbeiten, was Massenzahl und Ordnungszahl bedeuten und wie man Isotope erkennt. Mit vielen Beispielen und einfachen Erklärungen wirst du sicher im Umgang mit diesen grundlegenden Begriffen.
Die beschriebene Schreibweise ist eine kompakte Art, ein Atom darzustellen. Sie besteht aus dem Elementsymbol sowie zwei wichtigen Zahlen:
- Ordnungszahl (Z) – Anzahl der Protonen im Atomkern
- Massenzahl (A) – Summe aus Protonen und Neutronen
Die Schreibweise sieht wie in der Abbildung aus:
- X (C) ist das Elementsymbol
- Z (6) steht links unten
- A (12) steht links oben
Diese Darstellung findest du auch in der sogenannten Nuklidkarte und in vielen chemischen Formeln. Sie hilft dir, die Zusammensetzung eines Atoms schnell zu erkennen.
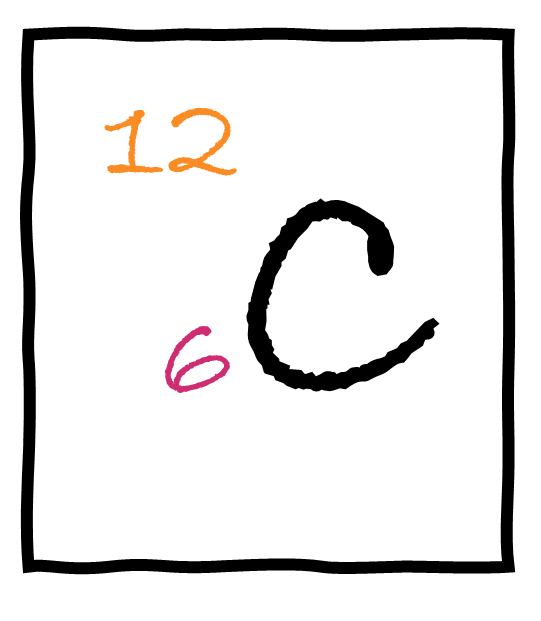
Ordnungszahl, Massenzahl & Nukleonenzahl
Die Ordnungszahl ist die wichtigste Information über ein Element. Sie gibt an, wie viele Protonen ein Atom besitzt. Da jedes Element eine feste Protonenzahl hat, bestimmt die Ordnungszahl eindeutig, um welches Element es sich handelt. Sauerstoff hat zum Beispiel immer 8 Protonen, Kohlenstoff immer 6. Die Massenzahl beschreibt die Gesamtzahl der Teilchen im Atomkern. Diese Teilchen heißen Nukleonen und bestehen aus:- Protonen
- Neutronen
Was sind Isotope?
Isotope sind Atome desselben Elements, die die gleiche Protonenzahl, aber eine unterschiedliche Neutronenzahl besitzen.
Dadurch haben sie verschiedene Massenzahlen, gehören aber weiterhin zum gleichen Element.
Isotope verhalten sich chemisch fast identisch, unterscheiden sich jedoch in ihrer Masse. Einige Isotope sind stabil, andere instabil und zerfallen radioaktiv.
Neutronenzahl berechnen – Wie funktioniert das?
Die Neutronenzahl ist besonders wichtig, um Isotope zu unterscheiden. Sie lässt sich leicht berechnen:
Neutronenzahl = Massenzahl – Ordnungszahl
Ein Beispiel:
- Kohlenstoff‑12: Massenzahl 12, Ordnungszahl 6
→ Neutronenzahl = 12 – 6 = 6 - Kohlenstoff‑14: Massenzahl 14, Ordnungszahl 6
→ Neutronenzahl = 14 – 6 = 8
Beide Atome gehören zum Element Kohlenstoff, unterscheiden sich aber in ihrer Neutronenzahl.
Fragen zum Video:
Häufige Fragen (FAQs)
Isotope sind Atome desselben Elements, die die gleiche Anzahl an Protonen, aber eine unterschiedliche Anzahl an Neutronen besitzen. Dadurch unterscheidet sich ihre Nukleonenzahl (Masse), während ihre chemische Identität gleich bleibt. Grundsätzlich kann man bei jedem Atom von einem Isotop sprechen, auch wenn es keine weiteren natürlichen Varianten dieses Elements gibt.
Die im PSE angegebene Masse ist ein Mittelwert der Atommassen aller natürlich vorkommenden Isotope eines Elements,. Dieser Wert berücksichtigt, in welchem prozentualen Verhältnis die einzelnen Isotope in der Natur vorkommen.
Beispiel Kohlenstoff: Der Wert 12,011 u ergibt sich primär aus der Verrechnung des Isotops C-12 (ca. 98,89 %) und des Isotops C-13 (ca. 1,11 %). Das instabile C-14 spielt aufgrund seines sehr seltenen Vorkommens für diese Berechnung keine Rolle.
Es gibt insgesamt 22 bekannte Reinelemente. Dies sind Elemente, bei denen in der Natur nur ein einziges Isotop existiert.
Bei einem ungeladenen Atom (kein Ion) ist die Anzahl der Elektronen identisch mit der Anzahl der Protonen. Das Atom ist dadurch nach außen hin elektrisch neutral.


