Redoxtitration
Nützliche Grundlagen – 12. Klasse Überblick
Bei der Redoxtitration benötigt man bereits durchgenommene Inhalte wie die Titration und die Redoxreaktionen, um durch die Kombination beider Themengebiete neue Aufgabenstellungen lösen zu können.
Neben der Kombination der beiden Inhalte wird hier in Aufgaben auch immer ein gewisses Grundwissen von den Lernenden erwartet. So wird in einigen Aufgaben zum Beispiel erwartet, dass Wasserstoffperoxid in einer Redoxreaktion zu Sauerstoff oxidiert. Es wird also in der Regel erwartet, dass man etwas über den Tellerrand hinausblicken kann.
Auch für die Oxidations- und Reduktionsgleichungen bietet es sich an, die gängigsten Bezeichnungen für Formeln und Verbindungen parat zu haben. Eine Auswahl dafür wird im folgenden Download zur Verfügung gestellt.
Eine Übersicht zum allgemeinen Ablauf einer Redoxreaktion kann man in der Abbildung erkennen. Dabei ist zu beachten, dass der Aufbau grundsätzlich der einfachen Säure-Base-Titration entspricht.
Fragen zum Video:
Weitere Redox-Titrationen (die man kennen sollte):
- Bromatometrie
- Iodometrie
- Wasserhärte-Bestimmung mit EriochromschwarzT
- Komplexometrie mit Ferroin
FAQ
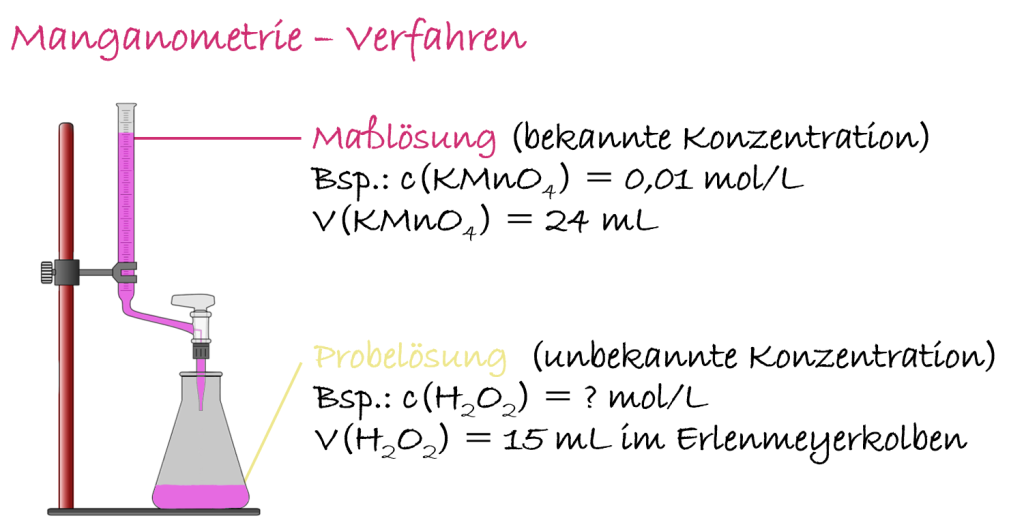
Die Manganometrie ist eine spezielle Art der Redoxtit., bei der Kaliumpermanganat (KMnO4) als Titrationsmittel verwendet wird. KMnO4 ist ein starkes Oxidationsmittel und hat eine charakteristische violette Farbe. Während der Titration werden die Manganationen (OZ: VII) zu farblosen Manganionen (OZ: II) reduziert. Der Äquivalenzpunkt ist sichtbar, da die violette Farbe von KMnO4 verschwindet, sobald kein Reduktionsmittel mehr vorhanden ist.
Der Äquivalenzpunkt in der Manganomet. wird durch die Entfärbung der Kaliumpermanganat-Lösung angezeigt. Sobald die gesamte zu oxidierende Substanz in der Probelösung reagiert hat, bleibt die violette Farbe des Permanganats bestehen.
Sowohl Manganomet. als auch Bromatometrie sind Redoxtit., die auf der Verwendung starker Oxidationsmittel basieren. Bei der Manganometrie wird Kaliumpermanganat (KMnO4) als Titrant verwendet, während bei der Bromatomet. Kaliumbromat (KBrO4) verwendet wird.
Weiterführender Themenbereich
Bestimmung der Wasserhärte:
- Wasserhärte = c(Erdalkalimetall-Ionen) im Wasser = c(Ca2+ + Mg2+) in mmol/L
- Wird auch in Grad deutscher Härte °dH oder °d angegeben
- Umrechnung über: °dH = c(Ca2+ + Mg2+) [mmol/L] * 5,6 wobei der Wert 5,6 der Umrechnungfaktor ist.
- Zur Bestimmung wird mithilfe von Eriochromschwarz T ein roter Komplex gebildet. Dieser Komplex wird durch Zugabe von EDTA zerstört wodurch am Äquivalenzpunkt die rote Farbe verschwindet.
Die Wasserhärte spielt im Alltag eine wichtige Rolle, da sie Einfluss auf Waschmittelverbrauch, Kalkablagerungen und die Lebensdauer von Haushaltsgeräten hat. Chemisch betrachtet gibt sie an, wie viele Calcium‑ und Magnesiumionen im Wasser gelöst sind. Je höher ihre Konzentration, desto „härter“ das Wasser. Bei der komplexometrischen Titration mit EDTA wird die gesamte Menge dieser Ionen erfasst, da EDTA beide Erdalkalimetalle sehr stabil bindet. Der Farbumschlag von Rot zu Blau zeigt dabei zuverlässig den Äquivalenzpunkt an. Die Methode ist präzise, schnell durchführbar und eignet sich hervorragend für Unterrichtsversuche, da sie den Zusammenhang zwischen Ionenkonzentration, Indikatorverhalten und Komplexbildung anschaulich vermittelt.
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!


