Quantenzahlen - Elektronenkonfiguration - Kästchenschreibweise
Nützliche Grundlagen – 12. Klasse Überblick:
Die Inhalte im Video gehören zur Überthematik Atombau und bilden den ersten Abschnitt für die zwölfte Klasse.
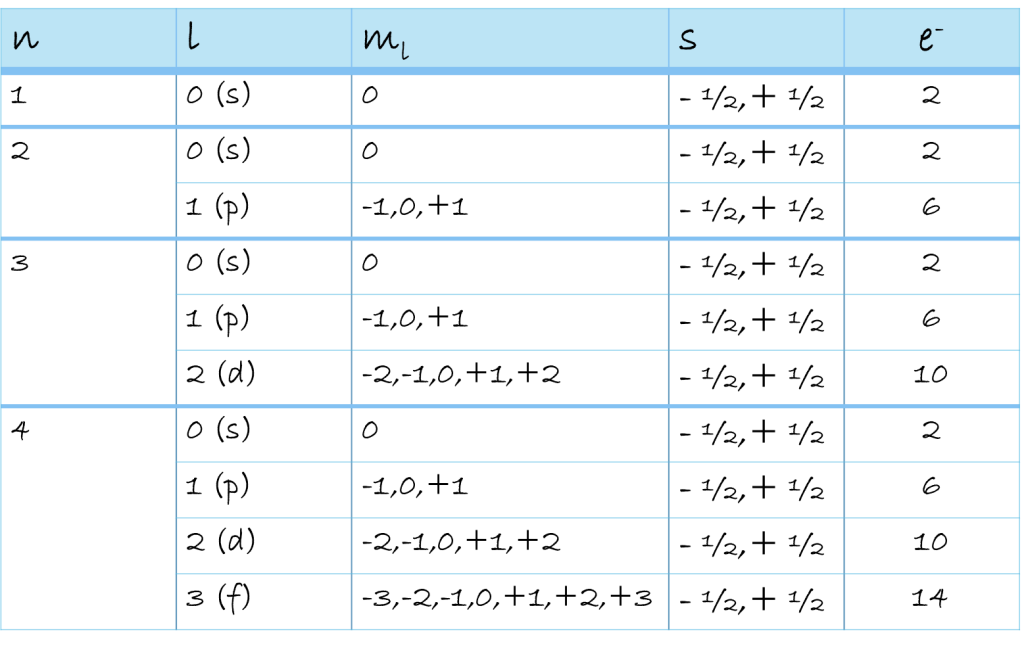
Es gibt vier Quantenzahlen, die für uns von Bedeutung sind:
- Hauptquantenzahl n
- Nebenquantenzahl l
- magnetische Quantenzahl ml
- Spinquantenzahl s
Mit diesen vier „Zahlen“ lässt sich zunächst das einfache Energiestufenmodell bis zu einer Feinstrukturaufspaltung erweitern und die einfache Elektronenkonfig. mit den Informationen bezüglich Orbitalen kombinieren. Den Abschluss bildet die Kästchenschreibweise, welche eine vereinfachte Darstellungsform der Feinstrukturaufspaltung ist.
Letztlich gibt es drei Punkte, welche man für die richtige Anwendung der Inhalte berücksichtigen sollte:
Das Pauli Prinzip: mindestens ein Unterschied pro Elektron
Die Hundsche Regel: zunächst einfache Besetzung energiegleicher Orbitale
Besetzung der Orbitale von energiearm zu energiereich
Wenngleich die Thematik am Anfang doch sehr komplex wirkt, ergibt sich der Großteil automatisch durch einen Blick in das Periodensystem der Elemente und dem Anwenden der Kästchenschreibweise und der Elektronenkonfiguration. Diese Thematik ist darüber hinaus mit einer Vielzahl von Ausnahmen gespickt und ermöglicht die Formulierung von Aufgaben, bei denen man mithilfe der Feinstrukturaufspaltung oder einer der anderen Darstellungsformen begründen kann, warum manche Ionen und damit Oxidationsstufen von Elementen stabiler als andere sind.
Orbitalmodell
Die Feinstrukturaufspaltung ist eine Erweiterung des einfachen Energiestufenmodells. Damit sieht man letztlich die einzelnen Orbitale des betrachteten Atoms oder Ions und wie diese besetzt sind. Damit kann man erklären, wieso ein bestimmtes Ion stabiler ist als ein anderes.
Eine bessere Begrifflichkeit ist hier die Oxidationsstufe. Vor allem bei den Nebengruppen-Elementen gibt es viele Metall-Elemente mit unterschiedlichsten Oxidationsstufen. Warum diese möglich und auch stabil sind, kann man mithilfe der Feinstrukturaufspaltung erklären.
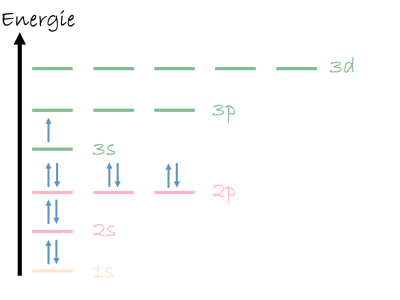
Im Hinblick auf chemische Bindungen hilft uns diese Darstellung auch, da einfach besetzte Orbitale durch die Ausbildung eines Molekülorbitals mit einem anderen Atom oder Ion eine Bindung ausbilden können. So gibt es beim Stickstoff-Atom drei einfach besetzte 2p-Orbitale. Mit einem anderen Stickstoff-Atom können diese über 3 Molekülorbitale voll besetzt werden. Dies entspricht der Dreifachbindung im Stickstoff-Molekül.
Die Elektronenkonfig. für das Calcium-Atom lautet: 1s22s22p63s23p64s2
Der Nachteil von dieser Darstellungsform ist, dass man nicht genau erkennt, wie die Orbitale besetzt sind. Dafür gibt es die Kästchenschreibweise, welche eine einfachere Methode darstellt, die Inhalte eines Energiestufendiagramms mit Feinstrukturaufspaltung zu zeigen.
Das tolle bei der ganzen Thematik ist, dass eigentlich alle notwendigen Informationen aus dem Periodensystem der Elemente abgelesen werden können.
Das ganze kann man einfach auf Ionen übertragen. So lautet die Elektronenkonfig. des Calcium-Kations Ca2+: 1s22s22p63s23p6
In der Regel werden bei der Bildung von Ionen aus den Elementen zunächst die Elektronen aus den s-Orbitalen abgegeben.
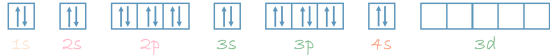
Ein weiteres Übungsbeispiel findet man in dem Element Gallium. Um Gallium und die 4p-Unterenergiestufe zu erreichen, müssen zunächst die 3d-Orbitale vollständig mit 10 Elektronen besetzt werden. Letztlich kann man fast alle Aufgaben dadurch lösen, dass man einen Finger auf das Wasserstoff-Atom legt und dann von links nach rechts bis zum gesuchten Element in einer Linie den Finger weiterzieht und bei jedem neuen Element ein Elektron hinzufügt. Wenn man bei einem Edelgas angekommen ist, muss man zur ersten Hauptgruppe in der nächsten Periode springen.
Fragen zum Video:
Tipps:
- Arbeite immer mit dem Periodensystem der Elemente und mache dich mit ihm vertraut.
- Mache dir vorab klar, wo Sonderfälle im PSE zu finden sind.
- Wenn die Sonderfälle nicht in deiner Formelsammlung vermerkt sind, lerne sie für eine Prüfung auswendig.
- Suche dir ein paar Hauptgruppen- und Nebengruppen-Elemente raus und formuliere jeweils alle Darstellungsformen bis du keine Fehler mehr machst.
- Bearbeite im nächsten Schritt Aufgaben mit Ionen.
Zum Weiterdenken:
- Wie hängt die ganze Thematik mit den Ionisierungsenergien zusammen?
FAQ
Quantenz. sind ein Satz von vier Zahlen, die den Zustand eines Elektrons in einem Atom beschreiben. Sie ermöglichen es, die Elektronenkonfiguration eines Atoms präzise darzustellen und die Feinstrukturaufspaltung der Energieniveaus zu verstehen. Mit Hilfe der Quantenz. kann man jedes Elektron in einem Atom eindeutig identifizieren.
Es gibt vier Arten von Quantenz.:
- Hauptquantenzahl (n): Beschreibt das Energieniveau des Elektrons und entspricht der Periode im Periodensystem (Werte 1 bis 7).
- Nebenquantenzahl (l): Beschreibt die Form des Orbitals (s, p, d, f) und teilt die Energieniveaus in Unterenergieniveaus auf (Werte von 0 bis n-1).
- Magnetische Quantenzahl (ml): Beschreibt die räumliche Orientierung des Orbitals im Magnetfeld (Werte von -l bis +l).
- Spinquantenzahl (s): Beschreibt den Eigendrehimpuls des Elektrons, den Spin (Werte +1/2 und -1/2).
- Pauli-Prinzip: In einem Atom dürfen keine zwei Elektronen in allen vier Quantenzahlen übereinstimmen. Maximal zwei Elektronen können sich in einem Orbital befinden, diese müssen sich in ihrem Spin unterscheiden.
- Hundsche Regel: Energiegleiche Orbitale werden zunächst einfach mit Elektronen gleichen Spins besetzt, bevor sie doppelt besetzt werden.
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!


