Das Massenwirkungsgesetz (= MWG)
Notwendige Grundlagen – 12. Klasse Überblick:
- Zunächst kannst du dich mit dem chemischen Gleichgewicht auseinandersetzen. Dies ist jedoch nach dem neuen Video nicht mehr unbedingt notwendig.
Weitere Themen aus dem Bereich Oberstufe:
- Das Bilden mesomerer Grenzstrukturformeln.
- Aus der Fischer-Projektion die Haworth-Projektion ableiten.
Das Massenwirkungsgesetz
Die Beispielaufgaben aus dem Erklärvideo können auch als Übung mithilfe der folgenden PDF genutzt werden.
Das Video behandelt die neuere, elegantere Version das MWG zu lösen. Grundsätzlich kann man natürlich auch die Aufgaben mithilfe des Videos zum chemischen Gleichgewicht lösen jedoch ist das etwas schwieriger. Wir stellen das MWG auf und berechnen unbekannte Größen, wie Kc oder eine Gleichgewichtskonzentration.
Um beim chemischen Gleichgewicht eine Gleichgewichtskonzentration zu bestimmen, muss zunächst mithilfe der Anfangskonzentration die verbrauchte Konzentration berechnen. Des Weiteren muss man die Stoffmengenverhältnisse der zu vergleichenden Stoffe berücksichtigen. Damit man weitere Berechnungen anstellen kann, muss man im Folgenden das MWG aufstellen. Dies erfolgt immer nach dem gleichen Prinzip und kann auf alle Aufgaben angewandt werden. Wie das funktioniert, wird in unserem Video erklärt.
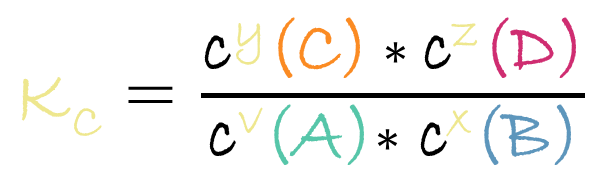
MWG einfach erklärt
Um das Thema besser zu verstehen, lohnt es sich, das Massenwirkungsges. zunächst aus einer konzeptionellen Perspektive zu betrachten. Das Massenwirkungsges. beschreibt mathematisch, wie sich ein chemisches Gleichgewicht einstellt und wie die Konzentrationen der beteiligten Stoffe im Gleichgewicht zueinander stehen. Obwohl die Formel auf den ersten Blick komplex wirken kann, folgt sie einem klaren und immer gleichen Muster. Genau dieses Muster macht das MWG so mächtig: Es lässt sich auf nahezu jede reversible Reaktion anwenden, unabhängig davon, ob es sich um eine einfache Gasreaktion oder ein komplexes System in Lösung handelt.
Das Massenwirkungsges. basiert auf der Idee, dass die Konzentrationen der Produkte im Verhältnis zu den Konzentrationen der Edukte stehen. Dabei werden die stöchiometrischen Koeffizienten aus der Reaktionsgleichung als Exponenten übernommen. Diese Struktur sorgt dafür, dass das Gesetz universell einsetzbar ist und gleichzeitig die tatsächlichen Stoffmengenverhältnisse korrekt abbildet. Im Unterricht wird häufig betont, dass das Massenwirkungsges. nicht nur ein mathematisches Werkzeug ist, sondern auch ein tieferes Verständnis für die Dynamik chemischer Reaktionen vermittelt. Genau das zeigt auch das Video auf deiner Seite: Es macht sichtbar, wie sich ein Gleichgewicht einstellt und wie sich Konzentrationen verändern, bis ein stabiler Zustand erreicht ist.
Gleichgewichtskonstante
Ein zentraler Bestandteil des Massenwirkungsges. ist die sogenannte Gleichgewichtskonstante, häufig als Kc bezeichnet. Sie gibt an, wie weit eine Reaktion im Gleichgewicht auf der Seite der Produkte oder der Edukte liegt. Ein großer Wert bedeutet, dass im Gleichgewicht überwiegend Produkte vorliegen, während ein kleiner Wert darauf hinweist, dass die Edukte dominieren. Diese Konstante ist für jede Reaktion charakteristisch und hängt ausschließlich von der Temperatur ab. Das bedeutet: Wird die Temperatur verändert, verschiebt sich nicht nur das Gleichgewicht, sondern auch der Wert von Kc.
Die Gleichgewichtskonstante ist ein wichtiges Werkzeug, um chemische Systeme vorherzusagen und zu verstehen. In der Oberstufe spielt sie eine große Rolle, weil sie hilft, Reaktionen quantitativ zu beschreiben. Das Video auf deiner Seite zeigt anschaulich, wie man Kc aus gegebenen Konzentrationen berechnet und wie man aus einem bekannten Kc-Wert Rückschlüsse auf die Lage des Gleichgewichts ziehen kann. Besonders hilfreich ist dabei die strukturierte Vorgehensweise: Anfangskonzentrationen bestimmen, Veränderung berechnen, Gleichgewichtskonzentrationen einsetzen und schließlich die Konstante berechnen. Diese Schritte lassen sich auf jede Aufgabe anwenden und geben Lernenden Sicherheit im Umgang mit dem MWG.
MWG Beispiele
Um das Verständnis weiter zu vertiefen, lohnt sich ein Blick auf typische Aufgabenstellungen, wie sie auch im Video behandelt werden. Ein klassisches Massenwirkungsges. Beispiel beginnt mit einer Reaktionsgleichung, aus der die stöchiometrischen Verhältnisse hervorgehen. Anschließend werden Anfangskonzentrationen angegeben, aus denen sich die Veränderungen während der Reaktion ableiten lassen. Diese Veränderungen werden häufig in Tabellenform dargestellt, was den Überblick erleichtert und Fehler reduziert.
Ein gutes Massenwirkungsges. Beispiel zeigt außerdem, wie wichtig es ist, die Exponenten korrekt zu setzen und nur die Stoffe in das Massenwirkungsges. aufzunehmen, die tatsächlich in Lösung oder im Gasraum vorliegen. Feststoffe und reine Flüssigkeiten werden nicht berücksichtigt, da ihre Konzentration konstant bleibt. Solche Feinheiten sind entscheidend, um korrekte Ergebnisse zu erhalten. Das Video auf deiner Seite führt genau durch diese Schritte und zeigt, wie man typische Fehler vermeidet. Lernende können die Beispielaufgaben anschließend mithilfe der bereitgestellten PDF selbstständig üben und ihr Verständnis festigen.
Fragen zum Video:


