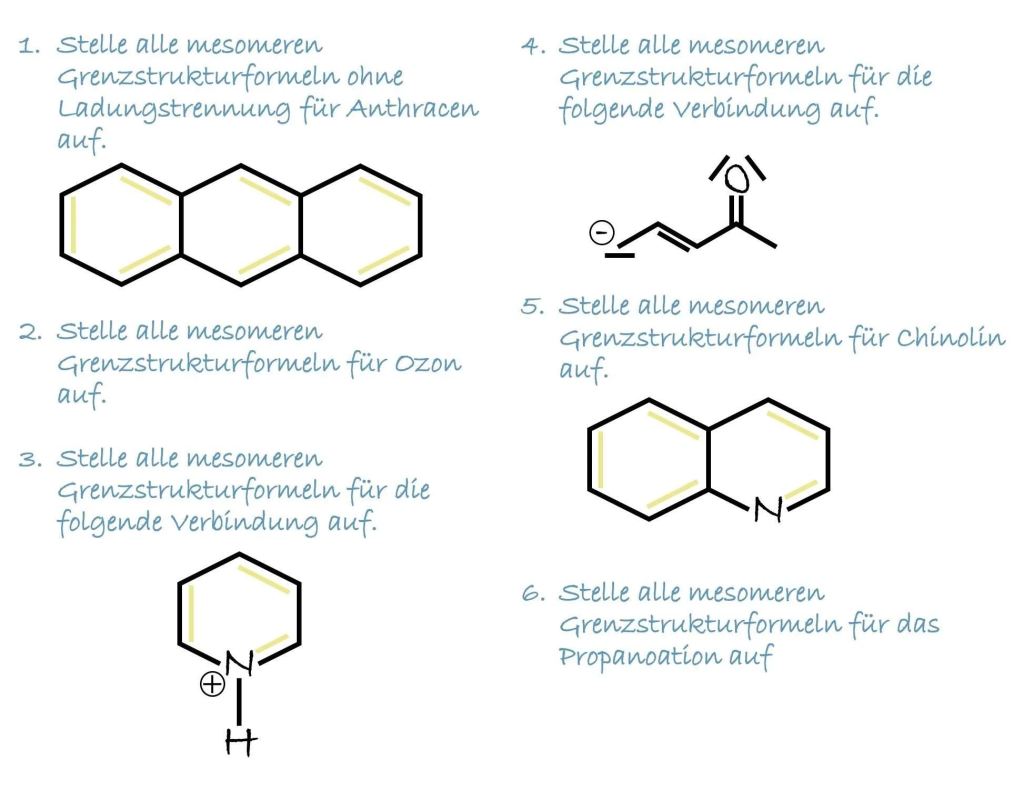
Notwendige Grundlagen – 12. Klasse Überblick:
- Das Aufstellen von Valenzstrichformeln
Mesomerie Erklärung
Das Aufstellen von mesomeren Grenzstrukturformeln wird fast ausschließlich ab der Oberstufe im Gymnasium benötigt. Mittlerweile wird auch in der Mittelstufe die gleichmäßige Elektronenverteilung bei Molekülen mithilfe der mesomeren Formeln erklärt und die Elektronendichteverteilung mithilfe von dreidimensionalen Modellen dargestellt.
In der Oberstufe bildet die Mesomerie die Grundlage, um z. B. das Reaktionsverhalten von Aromaten und Farbstoffen im Vergleich zu anderen Verbindungen erklären zu können.
Es handelt es sich prinzipiell um eine genauere Annäherung an die Realität als dies mit normalen Valenzstrichformeln (Lewis-Formeln) möglich ist. Um entsprechend argumentieren zu können, muss man natürlich zunächst Grenzstrukturformeln überhaupt formulieren können. Dies geschieht durch das Umklappen von Elektronenpaaren über, oder auf das angrenzende Atom.
Mesomerie Chemie – Schritt für Schritt erklärt
Ausgangsmolekül wählen
Wähle ein Molekül oder Ion mit delokalisierten Elektronen, z. B. das Nitrat-Ion NO3–
Typisch sind Systeme mit Mehrfachbindungen und freien Elektronenpaaren-
- Valenzstrichformel aufzeichnen
Zeichne zunächst eine mögliche Valenzstrichformel mit allen Valenzelektronen, Bindungen und freien Elektronenpaaren.
Achte darauf, dass die Oktettregel (bzw. Duettregel bei H) möglichst erfüllt ist und die Gesamtzahl der Elektronen stimmt.
- Elektronenbeweglichkeit erkennen
Suche nach Bereichen, in denen Elektronen „verschiebbar“ sind:- Doppelbindung neben Einfachbindung
- Ladung neben einer Mehrfachbindung
- Freies Elektronenpaar neben einer Mehrfachbindung
Nur Elektronen „wandern“, niemals Atomkerne oder Atome.
- Mesomere Grenzstrukturen zeichnen
Verschiebe nun Bindungselektronen oder freie Elektronenpaare Schritt für Schritt und zeichne jeweils eine neue Struktur:- Aus einer Doppelbindung kann eine Einfachbindung werden.
- Ein freies Elektronenpaar kann zu einer Doppelbindung werden.
- Formalladungen verschieben sich mit.
Verbinde die Strukturen mit einem Doppelpfeil (Resonanzpfeil), nicht mit einem Reaktionspfeil.
- Regeln überprüfen
Kontrolliere jede gezeichnete Grenzstruktur:- Gesamtzahl der Elektronen bleibt gleich.
- Atompositionen ändern sich nicht.
- Oktettregel ist soweit möglich erfüllt.
- Die Ladung des Gesamtteilchens bleibt gleich (z. B. immer -1 beim Nitrat-Ion).
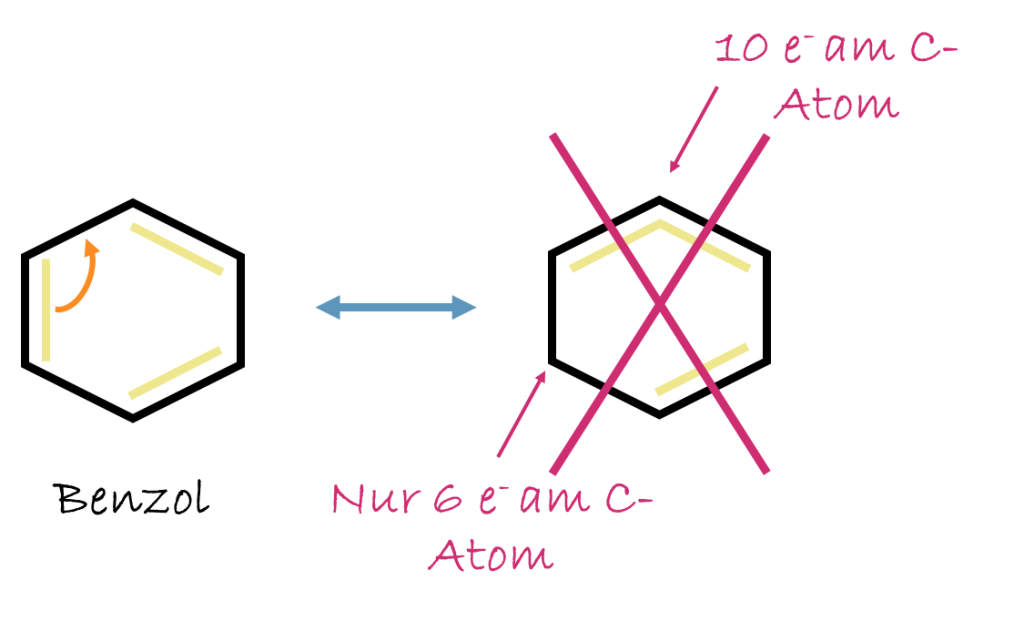
- Mesomeren Zustand verstehen
Das tatsächliche Molekül entspricht keiner einzelnen Grenzstruktur, sondern einem Mittel aus allen – dem mesomeren Zustand.
Die Elektronen sind delokalisiert, d. h. über mehrere Bindungen/Atome „verteilte“ Elektronenwolken, z. B. im Benzolring. Dies wird am offensichtlichsten wenn man die Bindungslängen von mesomeren Grenzstrukturen mit erwarteten Bindungslängen vergleicht.
- Stabilität und Bindungslängen deuten
Durch Mesomerie wird das System meist stabiler (mesomere Stabilisierung).
Oft sind Bindungslängen zwischen dem erwarteten Wert von Einfach- und Doppelbindung (z. B. im Benzol oder im Carboxylat-Ion).
Je mehr sinnvolle, energiearme Grenzstrukturen es gibt, desto stärker ist die mesomere Stabilisierung.
- Typische Fehler vermeiden
- Mesomerie nicht mit Isomerie verwechseln: Isomere haben unterschiedliche Atomverknüpfung, mesomere Strukturen nicht.
- Kein Verschieben von Atomen, nur von Elektronen.
- Keine Änderung der Gesamtelektronenzahl oder der Gesamtladung.
Im Alltag
Viele Stoffe, die uns täglich begegnen, verdanken ihre besonderen Eigenschaften einer feinen Verteilung von Elektronen innerhalb ihrer Teilchen. Diese Verteilung ist nicht starr, sondern kann sich über mehrere Bereiche eines Moleküls erstrecken. Dadurch entsteht eine Art „gemeinsame“ Elektronenwolke, die das gesamte Teilchen stabiler macht, als es eine einzelne, festgelegte Darstellung vermuten lässt.
Diese Stabilität spielt in vielen Bereichen unseres Lebens eine wichtige Rolle. Farben in Textilien oder Lebensmitteln behalten ihre Intensität, weil bestimmte Moleküle durch diese Elektronenverteilung weniger leicht zerfallen. Auch Duftstoffe funktionieren nur deshalb so zuverlässig, weil ihre Struktur auf diese Weise gefestigt wird und sie so in der Luft bestehen bleiben. In Medikamenten sorgt dieselbe Eigenschaft dafür, dass Wirkstoffe im Körper nicht sofort abgebaut werden, sondern ihre Aufgabe erfüllen können.
Sogar Materialien wie Kunststoffe, Lacke oder Farbstoffe verdanken ihre Beständigkeit dieser inneren Elektronenordnung. Sie beeinflusst, wie fest ein Stoff ist, wie gut er Licht absorbiert oder wie er auf andere Stoffe reagiert.
So zeigt sich, dass diese besondere Art der Elektronenverteilung weit mehr ist als ein theoretisches Konzept: Sie prägt die Eigenschaften vieler Stoffe, die unseren Alltag sicherer, farbiger und funktionaler machen.
Weitere Themen aus dem Bereich der Oberstufe:
- Wie erstellt man eine Haworth-Projektion aus einer Fischer-Projektion?
- Wie funktioniert das Massenwirkungsgesetz?
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!
Übungen:
Lösungsvideos:
Übung 20.09.2020: