+/- M Effekt & +/- I Effekt
Nützliche Grundlagen – 12. Klasse Überblick:
I Effekt einfach erklärt
Sowohl beim mesomeren als auch induktiven Effekt, kurz M– und I–Effekt können elektronenziehende Effekte, welche dann mit einem „–“ gekennzeichnet werden oder elektronenschiebende Effekte, welche entsprechend mit einem „+“ gekennzeichnet werden, auftreten. Folglich gibt es folgende vier Effekte welche berücksichtigt werden müssen:- + M
- – M
- + I
- – I
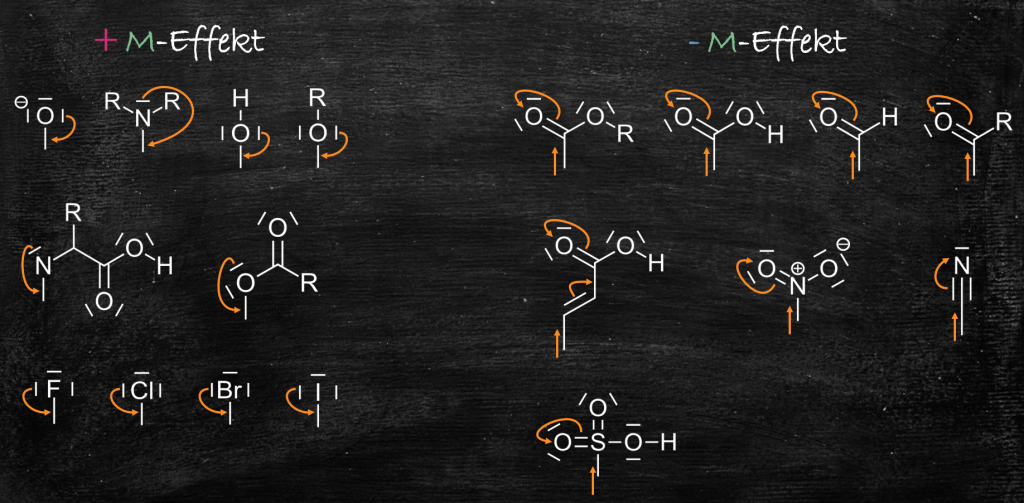
Die wichtigsten Substituenten und deren Valenzstrukturformeln sind in der Abbildung rechts dargestellt.
FAQ induktiver Effekt – mesomerer Effekt
Konjugierte Systeme, wie sie typischerweise in Benzolringen, Farbstoffen oder Vinylgruppen vorkommen, sind eine notwendige Voraussetzung für das Auftreten von M-Effekten. Die delokalisierten π-Elektronen in diesen Systemen ermöglichen die Verschiebung von Elektronendichte über mehrere Atome hinweg, was die Grundlage für mesomere Grenzstrukturen und somit für M-Effekte bildet. Ohne ein konjugiertes System kann kein M-Effekt auftreten.
Ein +M-Effekt tritt auf, wenn ein Substituent Elektronen in ein konjugiertes System hineinschiebt und somit die Elektronendichte im System erhöht. Dies geschieht in der Regel durch das Einklappen eines freien Elektronenpaars vom Substituenten in das konjugierte System. Beispiele hierfür sind das Phenolat-Anion oder Substituenten mit freien Elektronenpaaren am direkt gebundenen Atom (z.B. -OH, -NH₂). Ein -M-Effekt liegt vor, wenn ein Substituent Elektronen aus dem konjugierten System herauszieht und somit die Elektronendichte im System verringert. Dies geschieht oft durch das Aufklappen einer Mehrfachbindung zum elektronegativeren Atom des Substituenten, wodurch eine positive Ladung im konjugierten System entstehen kann (z.B. -NO₂, -CHO, -COOH).
Die Stärke von I Effekten wird hauptsächlich durch die Elektronegativität des Substituenten und seine Ladung bestimmt. Elektronegativere Atome oder positiv geladene Substituenten üben einen -I Effekt aus, da sie Elektronen anziehen. Weniger elektronegative Atome oder negativ geladene Substituenten sowie Alkylgruppen zeigen einen +I-Effekt, da sie Elektronen abstoßen oder weniger stark anziehen. Die Stärke des I-Effekts nimmt mit zunehmendem Abstand vom konjugierten System schnell ab.
Im direkten Vergleich sind M Effekte in der Regel wichtiger für die Reaktivität von organischen Verbindungen als I-Effekte. Wenn gegensätzliche M- und I-Effekte eines Substituenten auf ein Reaktionszentrum wirken, dominiert oft der M Effekt. Dies liegt daran, dass der M Effekt die Elektronendichte im gesamten konjugierten System und somit an potenziellen Reaktionszentren stärker beeinflusst als der lokalisiertere I Effekt.
Bei der Aufstellung mesomerer Grenzstrukturformeln für +M-Effekte klappt man typischerweise ein freies Elektronenpaar des Substituenten in das konjugierte System hinein, wodurch die Elektronendichte im System erhöht wird. Bei -M-Effekten klappt man Elektronen aus dem konjugierten System zum elektronegativeren Atom des Substituenten hin, wodurch eine positive Ladung im System entstehen kann. Wichtig ist dabei, die Oktettregel (außer bei bestimmten Atomen wie Schwefel in Sulfonsäuregruppen oder formal positiv geladenen Kohlenstoffatomen in bestimmten Grenzstrukturen) und die Formalladungen korrekt zu berücksichtigen. Grenzstrukturen, die zu Atomen mit mehr als acht Valenzelektronen (außer den genannten Ausnahmen) oder ungünstigen Ladungsverteilungen führen, sind in der Regel nicht relevant.
Ja, M- und I-Effekte können gleichzeitig in einem Molekül vorhanden sein und sich in ihrer Wirkung auf die Elektronendichte und Reaktivität überlagern. Beispielsweise zeigt Anilin einen -I-Effekt aufgrund der Elektronegativität des Stickstoffs und einen +M-Effekt durch das freie Elektronenpaar am Stickstoff, wobei der +M-Effekt hier stärker ist. Die resultierende elektronische Wirkung eines Substituenten ist oft die Summe oder das Zusammenspiel seiner individuellen M- und I-Effekte.
Ja, es gibt Fälle, in denen die Beschreibung des M-Effekts komplexer sein kann. Beispielsweise zeigen Halogene zwar einen -I-Effekt aufgrund ihrer hohen Elektronegativität, aber auch einen +M-Effekt durch ihre freien Elektronenpaare, wobei der -I-Effekt meist dominiert. Bei manchen Substituenten, wie der Sulfonsäuregruppe, kann die Oktettregel für zentrale Atome (hier Schwefel) überschritten werden, um resonanzfähige Grenzstrukturen zu erklären. In solchen Fällen ist ein tieferes Verständnis der elektronischen Struktur und Bindungsverhältnisse erforderlich, als es einfache „Regeln“ vermuten lassen.
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!


