Die Nomenklatur der Komplexe
Die Komplexchemie befasst sich mit Verbindungen, in denen ein zentrales Metallion von mehreren Liganden umgeben ist. Diese Liganden können neutral oder geladen sein und bestimmen gemeinsam mit dem Metall die Struktur, Stabilität und Reaktivität des entstehenden Komplexes. Eine zentrale Rolle spielt dabei die Koordinationszahl, also die Anzahl der Liganden, die direkt an das Metallion gebunden sind. Sie beeinflusst maßgeblich die räumliche Anordnung und die Eigenschaften des Komplexes. Viele charakteristische Merkmale – etwa Farbe, Magnetismus oder biologische Funktion – lassen sich erst durch das Verständnis dieser besonderen Bindungsverhältnisse erklären. Deshalb ist die Komplexchemie sowohl in der anorganischen Chemie als auch in Biochemie, Katalyse und Technik von großer Bedeutung.
Nützliche Grundlagen – 12. Klasse Überblick:
- Kästchenschreibweise (Anwendungsaufgaben)
- Benennung organischer Verbindungen
- Säure-Base-Chemie (Übersicht wichtige Ionen)
Nomenklatur Komplexe
Bei der Benennung der Komplexe handelt es sich um eine komplett neue Thematik, welche bisher nicht behandelt wurde. So kann mit ihrer Hilfe erklärt werden, warum Elemente mehr Bindungen ausbilden, als man das von der Position im Periodensystem der Elemente aus, erwarten würde. Die eckigen Klammern in der Summenformel beschreiben die sogenannten Koordinationseinheit, welche letztlich die Bindung zwischen dem Zentralteilchen = Elektronenakzeptor und den Liganden = Elektronenpaardonatoren umfasst. Die Bindung wird als koordinative Bindung bezeichnet und lässt sich als Bindungstyp verstehen, welcher zwischen der Ionenbindung und der kovalenten Bindung einzuordnen ist. Für die Benennung an sich treten viele Parallelen zur Benennung von organischen Verbindungen auf, weswegen man sich damit bereits sehr gut auskennen sollte.Eine PDF-Datei mit den gängigsten Liganden, organischen Liganden, Präfixe, griechische Präfixe und latinisierten Elementnamen gibt es hier zum Download:
Darüber hinaus empfiehlt es sich auch die gängigen Ionen aus der Säure-Base-Chemie zu kennen, da diese verwendet werden können, um aus dem Komplex-Ionen, Komplex-Salze aufzustellen.
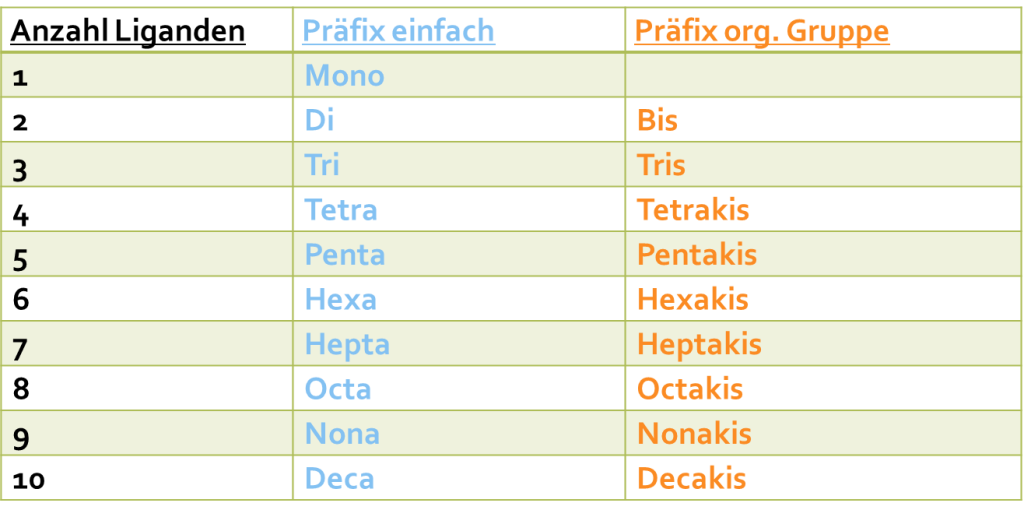
Tipps – Benennung Komplexe:
- Das Vorgehen zur Benennung ist immer dasselbe, das heißt man sollte zur Übung sehr viele Komplexe benennen
- Die Inhalte des PDFs sollte man verinnerlicht haben
- Online findet man teilweise andere Benennungen, so wurden früher für Liganden leicht abgewandelte Namen verwendet, wie „chloro“ anstelle von „chlorido“
Fragen zum Video:
FAQ
Auf der Teilchenebene spricht man von einem Komplex. Sobald man sich auf der Stoffebene befindet, handelt es sich um eine Komplexverbindung.
Die Koordinationseinheit umfasst alles, was in eckigen Klammern in einer Summenformel steht. Beispiel: [Co(en)₂(H₂O)₂]²⁺. Hier ist [Co(en)₂(H₂O)₂] die Koordinationseinheit.
Die Oxidationszahl des Zentralteilchens ergibt sich aus der Gesamtladung der Koordinationseinheit und den Ladungen der Liganden.
Der lateinische Name des Zentralteilchens mit der Endung „-at“ wird verwendet, wenn die Koordinationseinheit negativ geladen ist.
Bei der Benennung von Komplexsalzen wird das Kation vor dem Anion genannt.
- Beispiel: [Co(en)₂(H₂O)₂]SO₄ heißt Diaquabis(ethylendiamin)cobalt(II)-sulfat.
Die Beschäftigung mit der Komplexchemie eröffnet einen faszinierenden Blick auf die Vielfalt chemischer Strukturen und Bindungsarten. Wer die Grundlagen der Liganden, der räumlichen Anordnung und der systematischen Benennung beherrscht, legt damit den Grundstein für ein tieferes Verständnis vieler Bereiche der modernen Chemie. Ob in biologischen Systemen, in technischen Katalysatoren oder in farbintensiven Übergangsmetallverbindungen – Komplexe begegnen uns überall. Mit jedem weiteren Beispiel wächst die Sicherheit im Umgang mit Strukturen und Regeln, und scheinbar komplizierte Formeln werden zunehmend durchschaubar. Die Thematik bietet daher nicht nur theoretisches Wissen, sondern auch spannende Einblicke in reale Anwendungen. Es lohnt sich, weiter einzutauchen und die Vielfalt der Komplexchemie Schritt für Schritt zu entdecken.
Weiterführender Themenbereich
- Chemische Bindungen (in Arbeit)
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!


