Galvanische Zelle - Daniell-Element
Was du können solltest – 9. Klasse Überblick:
- Die Salzbildung
Solltet ihr noch Nachholbedarf haben, wiederhole das Kapitel. Es lohnt sich!
Aufbau Galvanischen Zelle – Galvanisches Element
Wir betrachten das Daniell-Element als Vertreter einer galvanischen Zelle. Es kommt zu einer Reaktion an derOxidation an der Anode
Zn → Zn2+ + 2 e–Reduktion an der Kathode
Cu2+ + 2 e– → Cu Die Reaktionen können nur gemeinsam ablaufen und bilden folgende Redoxreaktion: Zn + Cu2+ → Zn2+ + CuFunktionsweise galvanische Zelle Schritt für Schritt
Nach dem Prinzip der galvanischen Zelle werden Batterien und Akkus konstruiert. So benötigt man zwei räumlich voneinander getrennte Halbzellen, welche über einen elektrischen Leiter miteinander verbunden werden können und über eine Salzbrücke, die Ionen leiten kann, in Verbindung stehen. Nur durch diese Trennung der Reaktionspartner lässt sich der Elektronenfluss kontrolliert nach außen leiten und als elektrischer Strom nutzen.
In jeder Halbzelle befindet sich eine Elektrode, die in eine Elektrolyt-Lösung eintaucht. Die eine Elektrode wirkt als Anode, an der eine Oxidation stattfindet, während die andere Elektrode die Kathode bildet, an der eine Reduktion abläuft. Diese beiden Teilreaktionen laufen freiwillig ab, sobald ein elektrischer Kontakt zwischen den Elektroden hergestellt wird. Die Elektronen wandern dabei immer von der Anode zur Kathode, also von der Stelle, an der Elektronen abgegeben werden, zu der Stelle, an der sie aufgenommen werden.
Aufbau galvanische Zelle
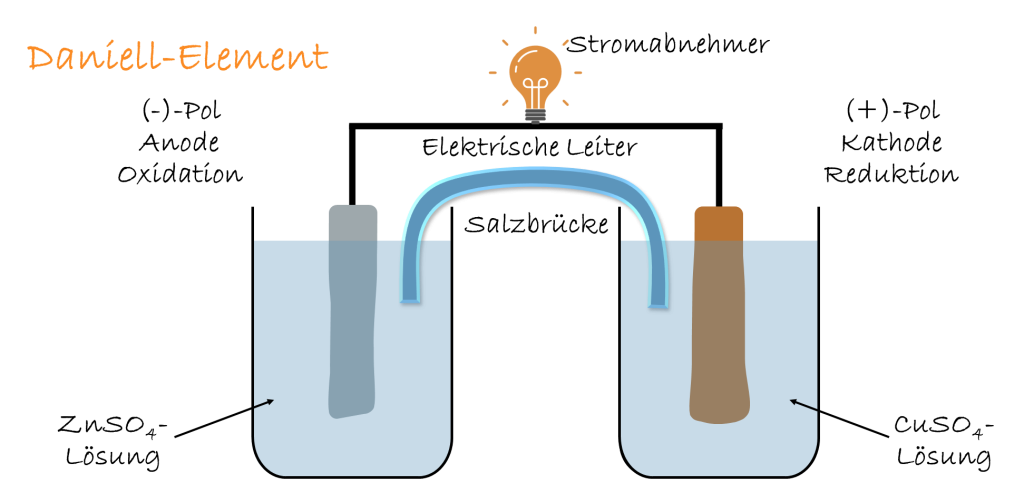
Die Salzbrücke spielt eine entscheidende Rolle für die Stabilität des Systems. Ohne sie würden sich die Lösungen in den Halbzellen elektrisch aufladen, da in der Anodenhalbzelle positive Ionen entstehen und in der Kathodenhalbzelle positive Ionen verschwinden. Die Salzbrücke sorgt durch den gerichteten Ionenaustausch dafür, dass die elektrische Neutralität in beiden Halbzellen erhalten bleibt. Ansonsten würde nach kurzer Zeit der Stromfluss zum Erliegen kommen.
Dieses Grundprinzip findet sich in nahezu allen Batterietypen wieder – von einfachen Zink-Kohle-Batterien bis hin zu modernen Lithium-Ionen-Akkus. Auch wenn die verwendeten Materialien und Elektrolyte stark variieren, bleibt die grundlegende Idee gleich: Eine chemische Reaktion wird räumlich getrennt, sodass Elektronen einen äußeren Weg nehmen müssen. Dadurch entsteht eine nutzbare elektrische Spannung.
Akku
Bei Akkumulatoren kommt ein weiterer Aspekt hinzu: Die chemischen Reaktionen sind reversibel. Das bedeutet, dass durch Anlegen einer äußeren Spannung die ursprünglichen Stoffe wiederhergestellt werden können. Während eine Batterie nach dem Entladen verbraucht ist, kann ein Akku durch das Umkehren des Elektronenflusses in seinen Ausgangszustand versetzt werden. Auch hier bleibt die Struktur aus zwei Halbzellen erhalten, nur dass der Elektronenfluss beim Laden umgekehrt wird.
Die galvanische Zelle ist somit nicht nur ein Schulbeispiel, sondern das grundlegende Funktionsprinzip hinter einem Großteil unserer modernen Energieversorgung im Alltag. Ob Fernbedienung, Smartphone oder Elektroauto – überall steckt die gleiche elektrochemische Idee dahinter: die kontrollierte Umwandlung von chemischer Energie in elektrische Energie.
Lithium-Ionen-Akku
besteht aus:
- zwei Elektroden:
- Anode (meist Grafit)
- Kathode (z. B. Lithium‑Metalloxid)
- einem Elektrolyten, durch den Lithium‑Ionen wandern können
- einem Separator, der die Elektroden trennt, damit sie sich nicht berühren
Beim Entladen
Wenn der Akku ein Gerät mit Strom versorgt:
- Lithium‑Ionen wandern von der Anode zur Kathode durch den Elektrolyten.
- Elektronen können diesen Weg nicht mitgehen und fließen deshalb außen herum durch das Gerät.
- Dieser Elektronenfluss ist der elektrische Strom, den wir nutzen.
Kurz gesagt:
Ionen innen, Elektronen außen → Strom fließt.
Beim Laden
Beim Laden passiert alles umgekehrt:
- Eine äußere Stromquelle „zwingt“ die Elektronen zurück zur Anode.
- Die Lithium‑Ionen folgen und wandern ebenfalls zurück zur Anode.
- Der Akku speichert dabei die elektrische Energie in Form von chemischer Energie.
Warum sind Lithium‑Ionen‑Akkus so beliebt?
- Sie haben hohe Energiedichte → viel Energie bei wenig Gewicht
- Sie lassen sich oft wieder aufladen
- Sie haben kaum Memory‑Effekt (= Problem bei älteren Akkus)
- Sie liefern stabile Spannung
FAQs zur galvanischen Zelle
Eine galvanische Zelle ist ein elektrochemischer Aufbau, der chemische Energie in elektrische Energie umwandelt. Sie besteht aus zwei Halbzellen, in denen Oxidation und Reduktion getrennt ablaufen.
Die Salzbrücke ermöglicht den Ionenaustausch zwischen den Halbzellen und verhindert eine Ladungsverschiebung. Ohne sie würde der Stromfluss stoppen.
Die beiden Metalle besitzen unterschiedliche Tendenzen, Elektronen abzugeben. Diese Differenz der Standardpotentiale erzeugt eine messbare Spannung
- Galvanische Zelle: chemische Energie → elektrische Energie (freiwillig)
- Elektrolyse: elektrische Energie → chemische Energie (erzwungen)
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!


