Energiestufenmodell und Elektronenkonfiguration
Das Verständnis der Elektronenverteilung in Atomen gehört zu den Grundlagen der Chemie. Viele Eigenschaften eines Elements – etwa seine Reaktivität, typische Bindungsarten oder die Ähnlichkeit zu anderen Stoffen – lassen sich direkt aus der Anordnung seiner Elektronen ableiten. Um diese Struktur verständlich zu machen, nutzt man häufig das Energiestufenmodell. Es zeigt, wie Elektronen in einem Atom organisiert sind und weshalb bestimmte Elemente vergleichbare chemische Verhaltensweisen zeigen. Im Gegensatz zum klassischen Schalenmodell, das oft zu der falschen Vorstellung führt, Elektronen würden wie Planeten um den Kern kreisen, beschreiben die hier verwendeten Modelle die Verteilung der Elektronen nach ihrem Energiegehalt deutlich genauer.
Wer die Elektronenverteilung eines Atoms mithilfe des PSEs bestimmen möchte, benötigt im Grunde nur zwei Informationen: die Ordnungszahl und die Reihenfolge der Energieniveaus. Mit etwas Übung lassen sich daraus sowohl neutrale Atome als auch positiv oder negativ geladene Ionen korrekt einordnen. Typische Fehler – etwa das falsche Auffüllen der Energieniveaus oder das Übersehen der Ladung eines Ions – lassen sich so leicht vermeiden.
Weiterführende Themen aus dem Bereich der 9. Klasse – Überblick:
- Die Bildung von Salzen
- Valenzstrichformeln aufstellen
- Die homologe Reihe der Alkane
Inhaltsverzeichnis
Das Energiestufenmodell – eine anschauliche Darstellung der Elektronenverteilung
Jedes Atom besitzt eine bestimmte Anzahl an Elektronen, die der Ordnungszahl im PSE entspricht. Diese Elektronen befinden sich jedoch nicht irgendwo im Raum, sondern sind auf klar definierte Energieniveaus verteilt. Man kann sich diese Niveaus wie Stockwerke in einem Gebäude vorstellen: Elektronen dürfen sich nur auf bestimmten „Etagen“ aufhalten, und jede Etage bietet nur eine begrenzte Anzahl an Plätzen.
Ein Energieniveau kann maximal acht Elektronen aufnehmen (in der Unter- & Mittelstufe). Erst wenn ein Niveau vollständig besetzt ist, wird das nächste aufgefüllt. Diese Regel erklärt, warum Atome mit ähnlicher Elektronenverteilung vergleichbare chemische Eigenschaften besitzen. Elemente einer Hauptgruppe haben beispielsweise die gleiche Anzahl an Elektronen im äußersten Energieniveau – und genau diese Elektronen bestimmen maßgeblich das Reaktionsverhalten. Da diese Elektronen besonders wichtig sind, bekommen sie eine eigene Bezeichnung: Die Valenzelektronen.
Kommt es zur Bildung eines Ions, verändert sich die Elektronenzahl. Gibt ein Atom Elektronen ab, entsteht ein positiv geladenes Ion, ein Kation; nimmt es Elektronen auf, wird es negativ geladen, ein Anion. Das Energiest.-modell zeigt dabei sehr übersichtlich, wie sich die Verteilung der Elektronen durch diese Veränderung verschiebt. Besonders bei Metallen und Nichtmetallen wird schnell klar, warum sie bevorzugt Elektronen abgeben oder aufnehmen.
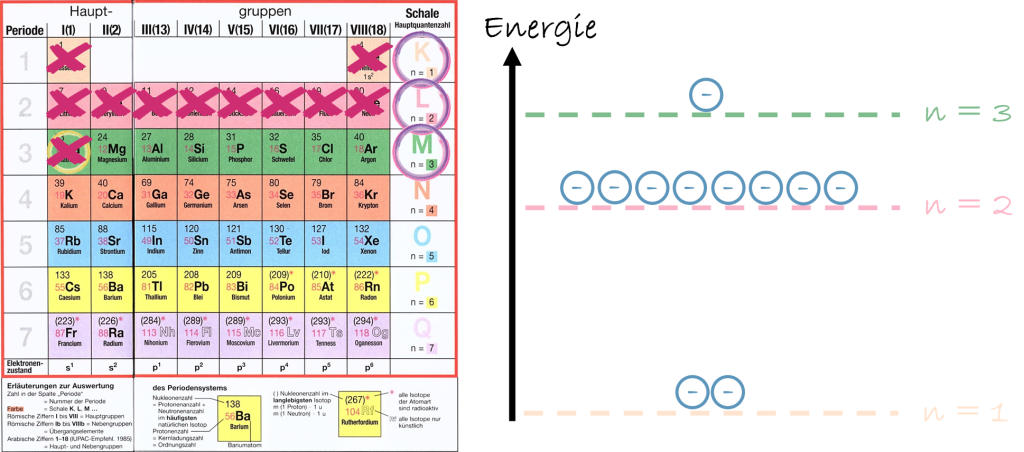
Die Elektronenkonfiguration – Schritt für Schritt aus dem Periodensystem (= PSE) ableiten
Auf dem oben behandelten Modell baut die Elektronenkonfiguration direkt auf. Sie beschreibt, wie viele Elektronen sich in den einzelnen Energieniveaus eines Atoms befinden. Um sie korrekt zu bestimmen, nutzt man das PSE als Orientierungshilfe.
Die Ordnungszahl gibt an, wie viele Elektronen ein neutrales Atom besitzt. Diese Elektronen werden dann der Reihe nach auf die Energieniveaus verteilt. Dabei gilt weiterhin: Ein Niveau kann höchstens acht Elektronen aufnehmen. Sobald ein Niveau voll ist, wird das nächste begonnen.
Im Lernvideo wird dieser Prozess Schritt für Schritt gezeigt. Besonders hilfreich ist es, zunächst einfache Beispiele zu betrachten – etwa Elemente der ersten oder zweiten Periode. Hier lässt sich gut erkennen, wie die Elektronen nacheinander die Energieniveaus füllen. Anschließend kann man komplexere Atome oder Ionen betrachten und die Verteilung selbstständig ableiten.
Bei Ionen ist ein zusätzlicher Schritt notwendig: Man muss berücksichtigen, ob Elektronen abgegeben oder aufgenommen wurden. Ein positiv geladenes Ion besitzt weniger Elektronen als das entsprechende neutrale Atom, ein negativ geladenes Ion entsprechend mehr. Die Elektronenkonfiguration verändert sich dadurch und genau diese Veränderung erklärt das chemische Verhalten vieler Stoffe.
Fragen zu den Videos:
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!
Lösungsvideos:
Übung 18.05.2023: Stufen
Erstelle das Energiestufenmodell für das Schwefel-Atom.
Erstelle das Energiestufenmodell für das Schwefel-Ion, welches in dem Salz Calciumsulfid gefunden werden kann.
Übung 17.05.2023: Konfiguration
Gib die Elektronenkonfiguration für die folgenden Atom-Elemente an: S, F, Cl, K
Gib die Elektronenkonfiguration für die folgenden Ionen an: S2-, F–, Cl–, K+
Die behandelte Thematik wird in der Oberstufe mit den Quantenzahlen erweitert. Wenn man sich intensiver mit der Struktur von Atomen beschäftigt, stößt man schnell auf ein Modell, das noch genauer beschreibt, wie Elektronen angeordnet sind. Während einfache Darstellungen vor allem zeigen, wie viele Elektronen sich auf verschiedenen Ebenen befinden, gehen Quantenzahlen einen Schritt weiter. Sie liefern ein detailliertes Koordinatensystem, das jedem Elektron einen eindeutigen „Adresspunkt“ zuweist.
Diese vier Zahlen geben Auskunft darüber, in welchem Energiebereich sich ein Elektron befindet, welche Form der Aufenthaltsraum besitzt, wie dieser Raum im Raum orientiert ist und wie sich das Elektron hinsichtlich seines Eigendrehimpulses verhält. Dadurch entsteht ein viel differenzierteres Bild, das nicht nur die Anzahl der Elektronen beschreibt, sondern auch ihre räumliche Verteilung und ihre quantenmechanischen Eigenschaften.
Mit diesem Ansatz lassen sich viele Phänomene erklären, die in einfacheren Modellen verborgen bleiben – etwa warum bestimmte Elemente besondere Stabilitäten aufweisen oder weshalb manche Elektronenpaare bevorzugt gemeinsam auftreten. Die Beschäftigung mit Quantenzahlen eröffnet somit den Zugang zu einem präziseren Verständnis der atomaren Struktur und bildet die Grundlage für weiterführende Themen wie Orbitalmodelle, Bindungstheorien und die Erklärung komplexer Stoffeigenschaften.


