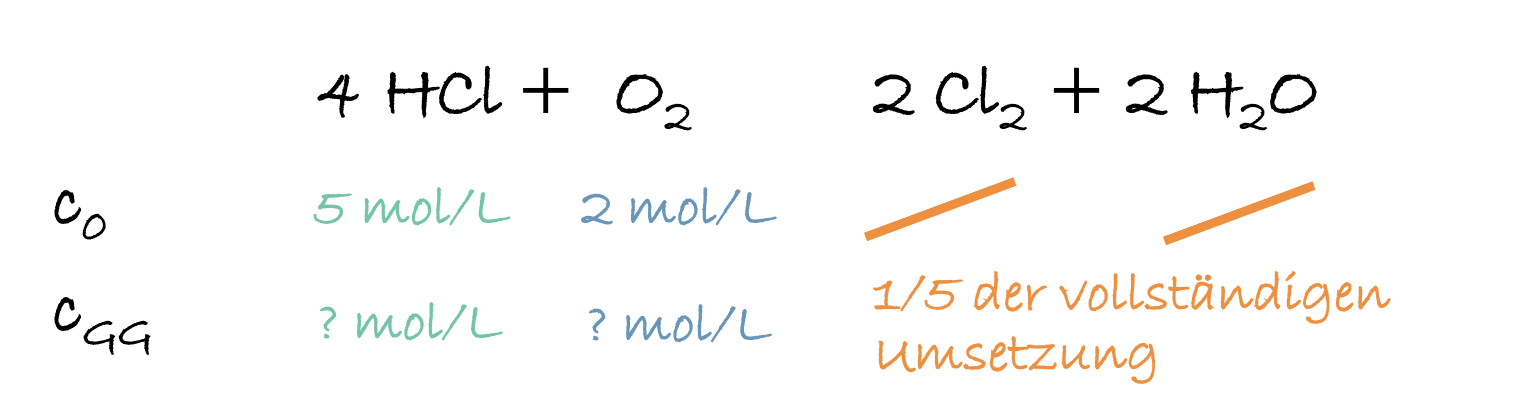Chemisches Gleichgewicht
Das chemische Gleichgewicht gehört zu den zentralen Konzepten der Oberstufenchemie und bildet die Grundlage für viele Prozesse, die uns im Alltag begegnen. Ob in Getränken mit Kohlensäure, in industriellen Synthesen wie dem Haber‑Bosch‑Verfahren oder in biologischen Systemen wie dem Blut‑pH – überall spielen reversible Reaktionen eine entscheidende Rolle. Damit du dieses abstrakte Thema besser verstehen, zeigt das Video auf dieser Seite Schritt für Schritt, wie sich ein Gleichgewicht einstellt, wie man es erkennt und wie äußere Bedingungen seine Lage beeinflussen. Der visuelle Zugang hilft dabei, die Dynamik hinter dem scheinbar „ruhigen“ Zustand zu begreifen.
Nützliche Grundlagen – 12. Klasse Überblick:
Gleichgewicht einfach erklärt – Gleichgewicht Chemie
Die Inhalte in diesem Video sind relativ umständlich und kompliziert. Mittlerweile gibt es ein eleganteres Vorgehen für das Lösen von Aufgaben zum MWG. Diese werden in einem anderen Video erklärt. Wer Interesse hat, kann sich jedoch damit auseinandersetzen, wie man früher an diese Aufgaben herangegangen ist.
Um beim chemischen Gleichgewicht eine Gleichgewichtskonzentration zu bestimmen, müssen wir zunächst mithilfe der Anfangskonzentration die verbrauchte Konzentration berechnen. Um diese Aufgaben richtig zu lösen, muss man die Stoffmengenverhältnisse der zu vergleichenden Stoffe berücksichtigen.
Ein chemisches Gleichgewicht entsteht immer dann, wenn eine Reaktion in beide Richtungen ablaufen kann: Die Edukte reagieren zu Produkten, und gleichzeitig können die Produkte wieder zu Edukten zurückreagieren. Anfangs dominiert meist die Hinreaktion, doch mit zunehmender Produktbildung gewinnt die Rückreaktion an Bedeutung. Schließlich erreicht das System einen Zustand, in dem sich die Geschwindigkeiten beider Reaktionsrichtungen ausgleichen. Dieser Zustand wirkt nach außen stabil, obwohl auf Teilchenebene weiterhin ununterbrochen Reaktionen stattfinden. Genau diese Dynamik ist ein Kernpunkt des Videos und wird dort anschaulich visualisiert.
Wichtig ist zu verstehen, dass ein Gleichgewicht nicht bedeutet, dass die Konzentrationen von Edukten und Produkten gleich groß sind. Vielmehr bleiben sie konstant, weil sich die Reaktionsgeschwindigkeiten ausgleichen. Je nach Reaktion kann das Gleichgewicht stark auf der Seite der Produkte oder der Edukte liegen. Das Video zeigt dies anhand typischer Beispiele und macht deutlich, wie man aus Beobachtungen auf die Lage des Gleichgewichts schließen kann.
Eine zentrale Rolle spielt das Massenwirkungsgesetz, das mathematisch beschreibt, wie die Konzentrationen der beteiligten Stoffe im Gleichgewicht zueinander stehen. Die Gleichgewichtskonstante K gibt an, ob eine Reaktion eher produkt- oder eduktsseitig liegt. Ein großer K-Wert bedeutet, dass im Gleichgewicht überwiegend Produkte vorliegen, während ein kleiner Wert auf eine bevorzugte Eduktseite hinweist. Im Video wird dieser Zusammenhang anhand einfacher Beispiele erklärt, sodass Lernende die Bedeutung von K intuitiv erfassen können.
Gleichgewicht Chemie
Besonders spannend wird das Thema, wenn äußere Bedingungen verändert werden. Temperatur, Druck und Konzentration können die Lage des Gleichgewichts verschieben. Das Prinzip von Le Chatelier beschreibt, wie ein System auf solche Störungen reagiert: Es weicht der Veränderung aus und stellt ein neues Gleichgewicht ein. Wird beispielsweise bei einer exothermen Reaktion die Temperatur erhöht, verschiebt sich das Gleichgewicht in Richtung der Edukte. Das Video zeigt diese Effekte mit klaren Grafiken und erleichtert so das Verständnis der zugrunde liegenden Gesetzmäßigkeiten.Besonders spannend wird das Thema, wenn äußere Bedingungen verändert werden. Temperatur, Druck und Konzentration können die Lage des Gleichgewichts verschieben. Das Prinzip von Le Chatelier beschreibt, wie ein System auf solche Störungen reagiert: Es weicht der Veränderung aus und stellt ein neues Gleichgewicht ein. Wird beispielsweise bei einer exothermen Reaktion die Temperatur erhöht, verschiebt sich das Gleichgewicht in Richtung der Edukte. Das Video zeigt diese Effekte mit klaren Grafiken und erleichtert so das Verständnis der zugrunde liegenden Gesetzmäßigkeiten.
Auch im Alltag lassen sich zahlreiche Beispiele finden, die das Konzept greifbar machen. Die Bildung und Zersetzung von Kohlensäure in Getränken erklärt, warum Sprudelwasser beim Öffnen der Flasche an Kohlensäure verliert. In der Industrie wird das Gleichgewicht gezielt beeinflusst, um Ausbeuten zu erhöhen – etwa durch hohen Druck bei der Ammoniaksynthese. Selbst im menschlichen Körper sorgen Gleichgewichte dafür, dass lebenswichtige Prozesse stabil bleiben, etwa bei Puffersystemen im Blut.
Das Video auf dieser Seite bietet einen idealen Einstieg in das Thema, da es die abstrakten Vorgänge auf Teilchenebene sichtbar macht. Die Kombination aus visueller Darstellung, klaren Erklärungen und typischen Beispielen erleichtert das Verständnis erheblich. Ergänzend dazu vertieft der Text die wichtigsten Konzepte und schafft eine solide Grundlage für weiterführende Themen wie Reaktionsgeschwindigkeit, Säure‑Base‑Gleichgewichte oder das Verhalten von Gasen.
So wird deutlich: Das chemische Gleichgewicht ist kein statischer Zustand, sondern ein fein abgestimmtes Zusammenspiel von Hin‑ und Rückreaktion. Wer diese Dynamik versteht, kann viele chemische Prozesse besser einordnen – im Unterricht, in Prüfungen und im Alltag.
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!
Übung:
1. Bestimme die Gleichgewichtskonzentrationen des folgenden Gleichgewichts:
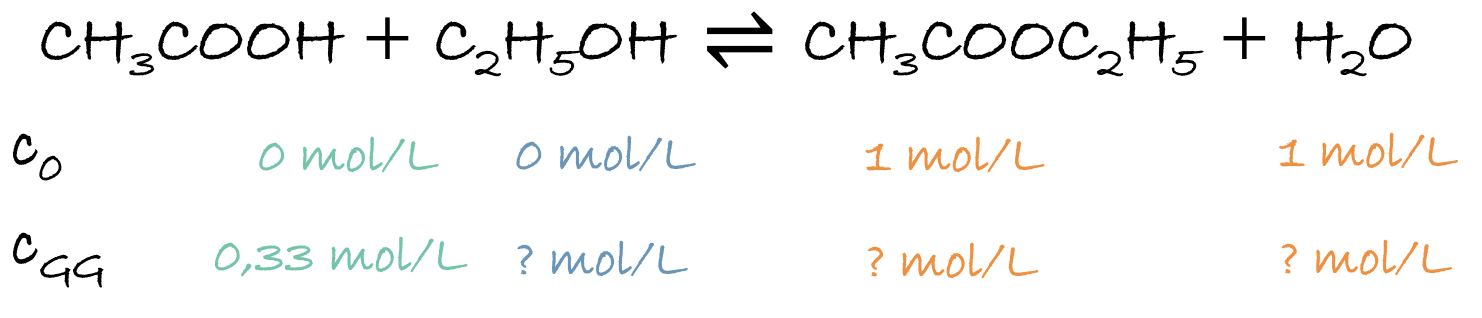
2. Bestimme die Gleichgewichtskonzentrationen des folgenden Gleichgewichts:
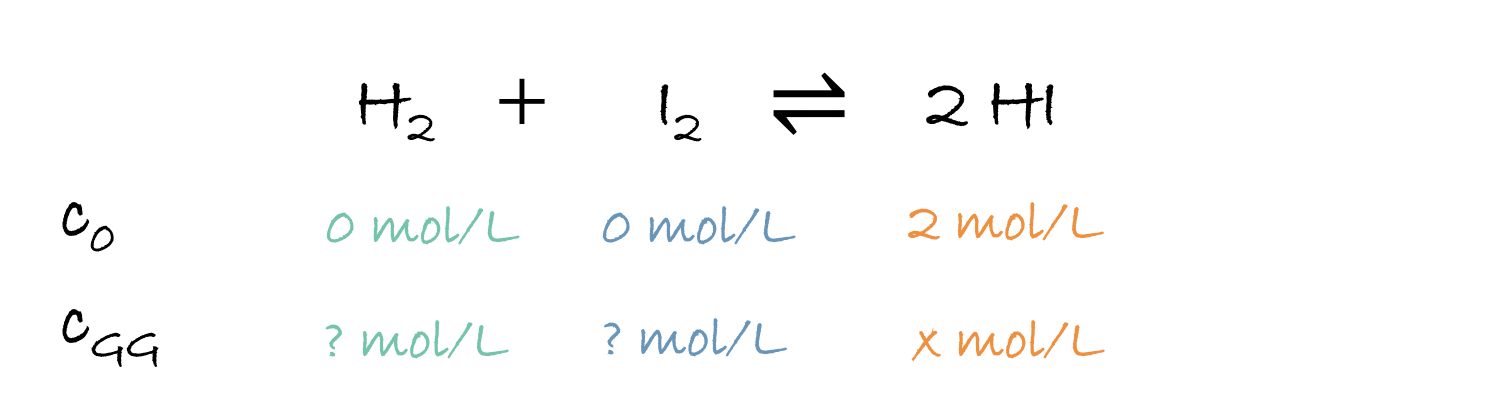
3. Bestimme die Gleichgewichtskonzentrationen des folgenden Gleichgewichts: