Die Wasserstoff Brennstoffzelle
Was du können solltest – 10. Klasse Überblick:
- Bestimmung von Oxidationszahlen.
- Aufstellen von Redoxreaktionen.
Solltet ihr noch Nachholbedarf haben, wiederholt die Kapitel. Es lohnt sich!
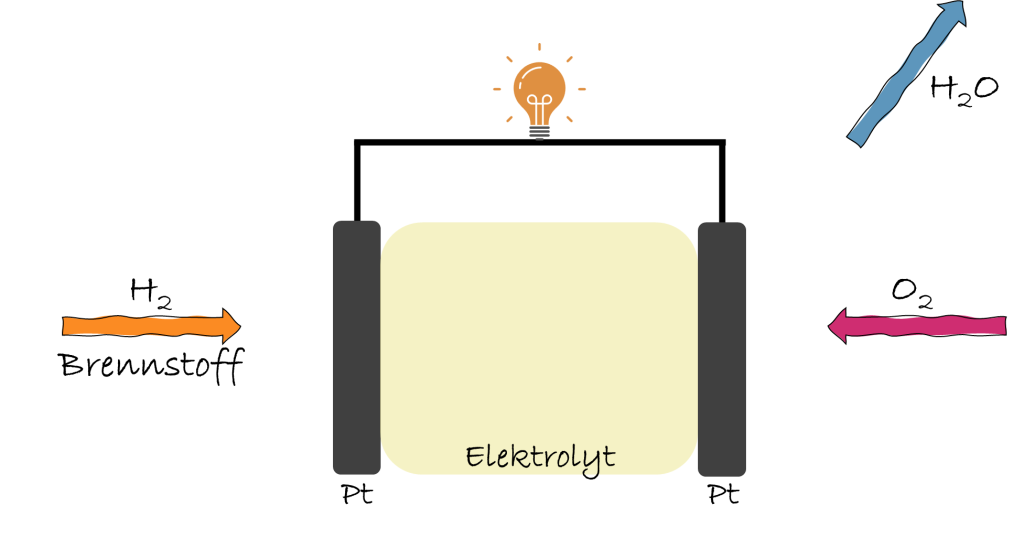
Aufbau und Funktionsprinzip
Im Video wird die Stoff- und Teilchenebene einer Wasserstoff‑Brennstoffzelle anschaulich erklärt. Dabei wurde bewusst auf alles Überflüssige verzichtet, um den Fokus auf die zentralen Prozesse zu legen.
Grundsätzlich lautet die Redoxreaktion dazu:
2 H2 + O2 → 2 H2O
mit den Teilreaktionen:
Anode (Oxidation): 2 H₂ → 4 H⁺ + 4 e⁻
Kathode (Reduktion): O₂ + 4 H⁺ + 4 e⁻ → 2 H₂
Eine häufige Fehlvorstellung besteht darin, dass in der Brennstoffz. „verbrannt“ wird – ähnlich wie in einem Diesel‑ oder Benzinmotor. Das ist jedoch nicht der Fall: Es entsteht keine Flamme. Stattdessen nutzt die Brennstoffz. dasselbe Prinzip wie eine galvanische Zelle. Die Oxidations‑ und Reduktionsreaktion der Redox-R. werden räumlich voneinander getrennt. Dadurch entsteht zwischen den beiden Reaktionsräumen ein gerichteter Elektronenfluss, der als elektrische Energie genutzt werden kann.
Fragen zum Video:
FAQ
Eine Brennstoffz. ist ein elektrochemisches Gerät, das chemische Energie aus einem Brennstoff und einem Oxidationsmittel direkt in elektrische Energie umwandelt. Im Gegensatz zu einer klassischen Verbrennung, wie man sie von einem Feuer oder einem Motor kennt, findet in einer Brennstoffz. keine Flammenbildung statt. Stattdessen nutzt sie eine kontrollierte Redoxreaktion, bei der der Brennstoff (z.B. Wasserstoff) oxidiert und Sauerstoff reduziert wird, um Elektronen zu erzeugen, die als elektrischer Strom genutzt werden können. Es handelt sich im Wesentlichen um eine räumlich getrennte Oxidation und Reduktion, ähnlich dem Prinzip einer galvanischen Zelle.
Eine Brennstoffz. benötigt zwei Elektroden: eine Anode (Minuspol) und eine Kathode (Pluspol), die über einen externen elektrischen Leiter verbunden sind. Zwischen den Elektroden befindet sich ein Elektrolyt (Ionenleiter), der den Transport von Ionen ermöglicht. An der Anode lagern sich H-Moleküle an und geben Elektronen und Protonen ab (Oxidation). Die Elektronen wandern über den elektrischen Leiter und erzeugen dabei elektrischen Strom, während die Protonen durch den Elektrolyten zur Kathode gelangen. An der Kathode nehmen Sauerstoffmoleküle die Elektronen und Protonen auf und reagieren zu Wassermolekülen (Reduktion). Katalysatoren, wie Platin, an den Elektroden ermöglichen diese Reaktionen.
Die Elektronen sind entscheidend für die Stromerzeugung. Sie werden an der Anode freigesetzt und wandern über den externen Stromkreis zur Kathode, wobei sie elektrische Energie liefern, die genutzt werden kann (z.B. um eine Lampe zum Leuchten zu bringen). Die Protonen (positiv geladene Wasserstoffkationen) wandern gleichzeitig durch den Elektrolyten von der Anode zur Kathode, um den Ladungsausgleich im System aufrechtzuerhalten und die Reaktion an der Kathode zu ermöglichen.
Ein wesentlicher Unterschied liegt in der Brennstoffzufuhr. Bei einer Brennstoffz. muss der Brennstoff (z.B. Wasserstoff) kontinuierlich zugeführt werden, um die Reaktion aufrechtzuerhalten und kontinuierlich Strom zu erzeugen. Batterien oder Akkus hingegen enthalten alle Reaktionspartner innerhalb ihrer Struktur und müssen nicht kontinuierlich mit Brennstoff versorgt werden. Sobald die internen Chemikalien aufgebraucht sind, ist die Batterie leer (oder muss bei einem Akku wieder aufgeladen werden).
Neben Wasserstoff können auch andere Brennstoffe wie Methan oder Methanol in Brennstoffz. eingesetzt werden. Der große Unterschied zu Wasserstoff besteht darin, dass diese Brennstoffe zusätzlich Kohlenstoff enthalten. Wenn Kohlenstoff oxidiert wird, entsteht Kohlenstoffdioxid (CO2). Dies bedeutet, dass die Wahl des Brennstoffs die Klimabilanz einer Brennstoffz. erheblich beeinflussen kann. Während Wasserstoff-Brennstoffz. nur Wasser als Produkt erzeugen, können Brennstoffz. mit kohlenstoffhaltigen Brennstoffen Treibhausgase freisetzen, was ihre Umweltfreundlichkeit mindert.
Nach den Grundlagen seid ihr jetzt für die kommenden Übungen gut gerüstet!


